置换反应
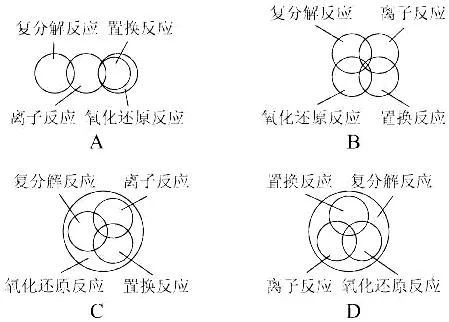
置换反应(displacement reaction)是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。它是一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应。
- 中文名 置换反应
- 外文名 displacement reaction
- 类型 无机化学反应
- 基本表示 A+BC=B+AC 或 AB+C=AC+B
基本含义
置换反应(displacement reaction)可表示为:
 置换反应
置换反应 A+BC=B+AC 或 AB+C=AC+B
通常认为置换反应多是氧化还原反应,但是一些特殊的反应,例如 金属羰基化合物间的置换,则不是氧化还原反应。
除此之外,也可以指路易斯酸间的置换反应,此时并不需要单质参与反应。出处是高等教育出版社的《无机化学》(第四版)下册第460页正文第3行:"……能将另一个较弱的路易斯酸MnF4从稳定配离子[MnF6] 2-的盐中置换出来"
分类标准
根据反应环境分类
根据反应环境的类别,置换反应有以下2种情况:
(1)固态置换在加热或高温条件下固体与固体或固体与气体发生的置换反应。
(2)液态置换在水溶液中进行的置换反应。
1.金属跟酸的置换
是金属原子与酸溶液中氢离子之间的反应。
要特别注意不能用浓硫酸,硝酸,它们有强氧化性,先将金属氧化成对应氧化物,氧化物再溶于酸中,然后继续氧化,继续溶解,反应得以继续
Zn+2HCl= ZnCl₂+H₂↑
Zn+H₂SO₄(稀硫酸) = ZnSO₄+H₂↑
2Al+3H₂SO₄(稀硫酸) = Al₂(SO₄)₃+3H₂↑
2.金属跟盐溶液的置换
是金属原子跟盐溶液中较不活泼金属的阳离子发生置换。如:
Cu+Hg(NO₃)₂ = Hg+Cu(NO₃)₂
根据元素性质分类
按元素的性质划分,金属与非金属单质间的置换。
1.金属单质置换金属单质
2Al+Fe₂O₃ =高温= Al₂O₃+2Fe (铝热反应。Al还可与V₂O₅.CrO₃.WO₃.MnO₂等发生置换)
Fe+CuSO₄ = FeSO₄+Cu
2.金属单质置换非金属单质
Zn+2HCl = H₂↑+ZnCl₂
2Na+2H₂O = 2NaOH+H₂↑
2Mg+CO₂ =点燃= 2MgO+C
3Fe+4H₂O(g) =高温= Fe₃O₄+4H₂
4Na+3CO₂ =点燃= 2Na₂CO₃+C
3.非金属单质置换金属单质
C+2CuO =高温= 2Cu+CO₂↑
 置换反应实验
置换反应实验 4.非金属单质置换非金属单质
2F₂+2H₂O = 4HF+O₂
2C+SiO₂ = Si+2CO ↑
C+H₂O =高温= CO+H₂
2H₂+SiCl₄ = Si+4HCl
Cl₂+2NaBr = Br₂+2NaCl
O₂+2H₂S = 2S↓+2H₂O
Br₂+2HI = 2HBr+I₂
根据元素周期表中位置分类
按元素在周期表的位置划分,同族元素单质间的置换与不同族元素单质间的置换。
1.同主族元素单质间的置换
Na+KCl =高温= NaCl+K↑(一般是774℃)
2Na+2H₂O = 2NaOH+H₂↑
2H₂S+O₂ = 2S+2H₂O
2C+SiO₂ = Si+2CO↑
F₂+2HCl = 2HF+Cl₂
2.不同主族元素单质间的置换
Mg+2HCl = MgCl₂+H₂↑
2Mg+CO₂ = 2MgO+C
2Al+6HCl = 2AlCl₃+3H₂↑
2F₂+2H₂O = 4HF+O₂
C+H₂O(g)=高温= CO+H₂
2H₂+SiCl₄ = Si+4HCl
H₂S+Cl₂ = S+2HCl
3Cl₂+8NH₃ = 6NH₄Cl+N₂
4NH₃+3O₂ =点燃= 2N₂+6H₂O (氨气在纯氧中燃烧)
3.主族元素单质置换副族元素的单质
2Al+Fe₂O₃ = Al₂O₃+2Fe
C+CuO = Cu+CO↑
4Na+TiCl₄ = 4NaCl+Ti
4.副族元素的单质置换主族元素单质
3Fe+4H₂O(g)=加热= Fe₃O₄+4H₂
5.副族元素的单质置换副族元素的单质
Fe+CuSO₄ = FeSO₄+Cu
根据物质类别分类
按物质类别划分,单质与氧化物间的置换和单质与非氧化物间的置换。
1.单质与氧化物发生置换反应
2Na+2H₂O = 2NaOH+H₂↑
2Mg+CO₂ =点燃= 2MgO+C
3Fe+4H₂O = Fe₃O₄+4H₂↑
C+FeO =高温= Fe+CO↑
2F₂+2H₂O = 4HF+O₂↑
2C+SiO₂ = Si+2CO↑
2Al+Fe₂O₃ = Al₂O₃+2Fe
C+H₂O(g)=高温= CO+H₂
Si+2FeO = 2Fe+SiO₂
2.单质与非氧化物发生置换反应
2H₂+SiCl₄ = Si+4HCl
H₂S+Cl₂ = S+2HCl
3Cl₂+8NH₃ = 6NH₄Cl+N₂
4NH₃+3O₂ = 2N₂+6H₂O
Mg+2HCl = MgCl₂+H₂↑
2Al+6HCl = 2AlCl₃+3H₂↑
液态置换遵守金属活动性顺序。
氧化还原反应不一定为置换反应,置换反应一定为氧化还原反应。
另外需要注意的是置换反应是根据金属活泼性顺序表发生的。
金属活性表
Fr 钫 | Cs 铯 | Rb 铷 | K 钾 | Ra 镭 | Ba 钡 | Sr 锶 | Ca 钙 | Na 钠 | Li 锂 | Ac 锕 |
La 镧 | Ce 铈 | Pr 镨 | Nd 钕 | Pm 钷 | Sm 钐 | Eu 铕 | Gd 钆 | Tb 铽 | Y 钇 | Mg 镁 |
Dy 镝 | Am 镅 | Ho 钬 | Er 铒 | Tm 铥 | Yb 镱 | Lu 镥 | (H) (氢) | Sc 钪 | Pu 钚 | Th 钍 |
Np 镎 | Be 铍 | U 铀 | Hf 铪 | Al 铝 | Ti 钛 | Zr 锆 | V 钒 | Mn 锰 | Nb 铌 | Zn 锌 |
Cr 铬 | Ga 镓 | Fe 铁 | Cd 镉 | In 铟 | Tl 铊 | Co 钴 | Ni 镍 | Mo 钼 | Sn 锡 | Pb 铅 |
(D₂) (氘分子) | (H₂) (氢分子) | Cu 铜 | Tc 锝 | Po 钋 | Hg 汞 | Ag 银 | Rh 铑 | Pd 钯 | Pt 铂 | Au 金 |
实例
其中10号氢是过渡元素它前面的可以置换出氢,它后面的则不可以。也就是说氢前面的可以和酸反应生成 氢气,而氢后面的基本不和酸反应就算反应也不生成氢气.
(1)金属单质 + 酸 -- 盐 + 氢气
1、锌和稀硫酸反应:Zn + H₂SO₄ = ZnSO₄ + H₂↑
2、锌和稀盐酸反应:Zn + 2HCl = ZnCl₂ + H₂↑
3、铝和稀硫酸反应:2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂↑
4、铝和稀盐酸反应:2Al + 6HCl = 2AlCl₃ + 3H₂↑
5、镁和稀盐酸反应:Mg+ 2HCl = MgCl₂ + H₂↑
6、镁和稀硫酸反应:Mg + H₂SO₄ = MgSO₄ + H₂↑
1~6的现象:有气泡产生。
7、铁和稀盐酸反应:Fe + 2HCl = FeCl₂ + H₂↑
8、铁和稀硫酸反应:Fe + H₂SO₄ = FeSO₄ + H₂↑
7~8铁参加的置换反应显+2价,7~8的现象:有气泡产生,溶液由无色变成浅绿色。
(2)金属单质 + 盐(溶液)--另一种金属 + 另一种盐
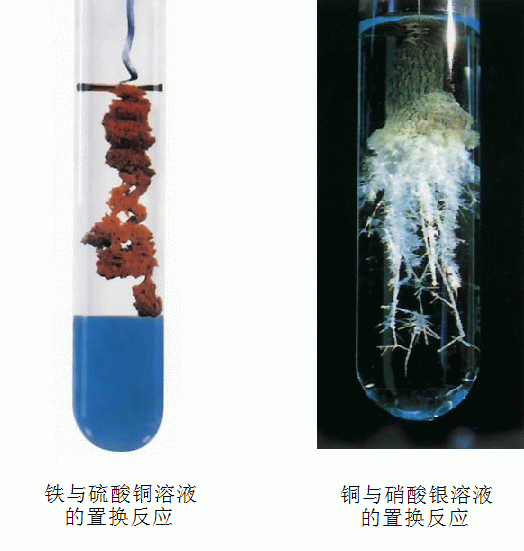
9、铁与硫酸铜反应:Fe+CuSO₄ = Cu+FeSO₄
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
10、锌片放入硫酸铜溶液中:CuSO₄ + Zn = ZnSO₄ + Cu
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
11、铜片放入硝酸银溶液中:2AgNO₃+Cu = Cu(NO₃)₂+2Ag
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。
(3)金属氧化物+木炭或氢气→金属+二氧化碳或水
12、焦炭还原氧化铁:3C+ 2Fe₂O₃ =高温= 4Fe + 3CO₂↑(冶炼金属)
现象:红色粉末变成黑色,澄清石灰水变浑浊。
13、木炭还原氧化铜:C+ 2CuO =高温= 2Cu + CO2↑(冶炼金属)
现象:红色粉末变成黑色,澄清石灰水变浑浊。
14、氢气还原氧化铜:H2+CuO=高温=H2O+Cu
现象:黑色粉末变成红色,试管内壁有水珠生成
15、氢气与氧化铁反应:3H2+Fe2O3=高温=2Fe+3H2O
16、水蒸气通过灼热碳层:H₂O(g)+ C =高温= H2 + CO(水煤气的制法)