离子键
离子键是化学键的一种,通过两个或多个原子失去或获得电子而成为离子后形成。此类化学键往往在金属与非金属间形成。
- 中文名 离子键
- 外文名 Ionic bond
- 性 质 化学键的一种
基本简介
离子键 (ionic bond)指阴离子、阳离子间通过静电作用形成的化学键(特殊的除外,如:氯离子和铝离子,铝离子和溴离子,它们之间形成的化合物是共价化合物)。
 离子键
离子键 离子键,又被称为盐键,是化学键的一种,通过两个或多个原子或化学基团失去或获得电子而成为离子后形成。带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时, 表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。因此,离子键是阳离子和阴离子之间由于静电作用所形成的化学键。
形成原因
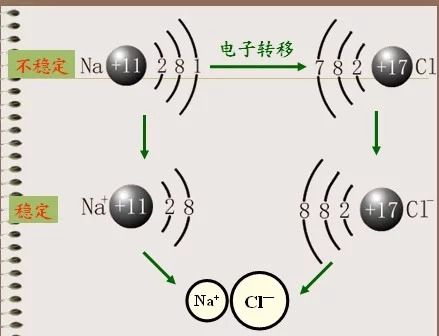
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如Na+、Cl⁻;也可以由原子团形成;如SO4 2⁻,NO3⁻等。
研究认为,在分子或晶体中的原子决不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫做化学键。键的实质是一种力。所以有的又叫键力,或就叫键。
定义
使带相反电荷的阴离子和阳离子结合的相互作用,称之为离子键
组成
由活泼金属阳离子和活泼非金属阴离子组成
键的本质
阴离子和阳离子之间的静电作用
影响离子键强弱的因素
阴阳离子的半径的大小;阴阳离子电荷的多少
电子式
在元素符号周围用“· ”或“×”来表示原子最外层电子的式子
基本特点
基本性质
离子键的作用力强,无饱和性,无方向性。
离子键存在于离子化合物中,离子化合物在室温下是以晶体形式存在。
离子键较氢键强,其强度与共价键接近。
阴阳离子是否中和
也许有人会问,阴阳离子结合在一起,彼此电荷是否中和呢?钠离子和氯离子之间除了有静电相互吸引作用外,还有电子与电子,原子核与原子核之间的相互排斥作用。当两种离子接近到某一定距离时,吸引与排斥达到了平衡,于是阴阳离子之间就形成了稳定的化学键。所以,所谓阴阳离子电荷相互中和的现象是不会发生的。
晶格能
离子键的键能比较大,反映在离子化合物中就是高熔沸点,离子键的键能被称作晶格能,晶格能的符号与离子晶体解离过程焓变的符号保持一致。晶格能可以通过玻恩-哈勃循环(Bōrn-Haber cycle)或玻恩-兰德公式(Bōrn-Landé)计算得出,也可以通过实验测量测量。