电解池
电解池的主要应用用于工业制纯度高的金属,是将电能转化为化学能的一个装置(构成:外加电源,电解质溶液,阴阳电极)。使电流通过电解质溶液或熔融电解质而在阴,阳两极引起还原氧化反应的过程。
- 中文名 电解池
- 外文名 Electrolytic cell
- 主要应用 制纯度高金属氯碱工业防金属腐蚀
- 构成 外加电源,电解质溶液,阴阳电极
- 概念 氧化还原反应的过程电解原理
基本内容
基本概念
(1)使电流通过电解质溶液或熔融的电解质而在阴、阳两极上引起还原氧化反应的过程叫做电解。
(2)把电能转变为化学能的装置叫做电解池或电解槽。
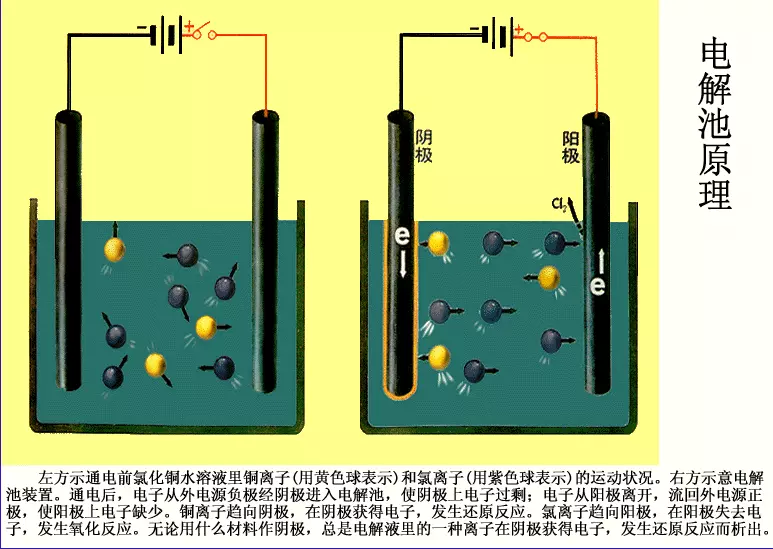
(3)当离子到达电极时,失去或获得电子,发生氧化还原反应的过程电解原理(电解池装置如图)
阴极:与电源负极相连的电极。(得电子发生还原反应)
阳极:与电源正极相连的电极。(失电子发生氧化反应)
电解定义
电解是使电流通过电解质溶液(或者是熔融的电解质)
而在阴、阳两极引起还原氧化反应的过程。
上图是电解CuCl2溶液的装置。
通电后发生反应:
CuCl2=(电解)Cu+Cl2
阳极:2Clˉ - 2e- → Cl2 ↑
阴极:Cu2- + 2e- -→ Cu
电解过程中的能量转化(装置特点)一定不参与反应 不一定是惰性电极阳极:不一定参与反应 也不一定是惰性电极
反应条件
①连接直流电源
②阴阳电极 阴极:与电源负极相连为阴极
阳极:与电源正极相连为阳极
③两极处于电解质溶液或熔融电解质中
④两电极形成闭合回路
电极反应
电极反应与电源的正极相连的电极称为阳极。
物质在阳极上失去电子,发生氧化反应。如上图装置中,Cl在阳极上失去电子转化为Cl2,阳极反应式:2Cl -2e=Cl2↑简记为阳氧。
与电源的负极相连的电极成为阴极。
物质在阴极上得到电子,发生还原反应。如上图装置中,Cu在阴极是得到电子转化为Cu,阴极反应式:Cu+2e→Cu简记为阴原(阴原)
电解结果
在两极上有新物质生成
反应规律
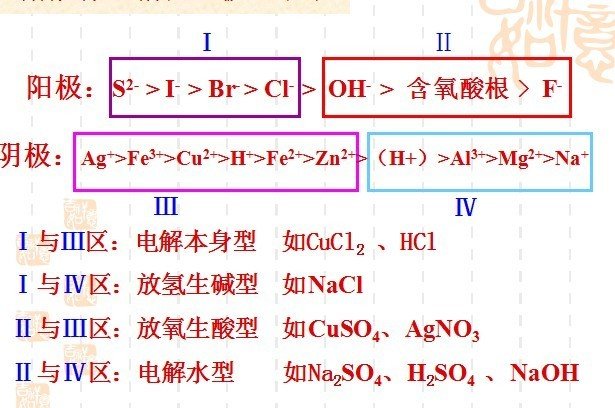
阳极:活泼金属-电极失电子(Au,Pt除外);
惰性电极-溶液中阴离子失电子
失电子能力:活泼金属(除Pt,Au)>S>I>Br>Cl>OH>含氧酸根(NO>SO4)>F
阴极:溶液中阳离子得电子能力:Ag>Hg>Fe>Cu>H(酸)>Pb>Sn>Fe>Zn>H(水)>Al>Mg>Na>Ca>K(即金属活泼性顺序表的逆向)
规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
四类电解型的电解规律(当阳极为惰性电极时)
①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。电解质溶液复原-加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。电解质溶液复原-加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。电解质溶液复原-加阴离子相同的酸。
④放氧生酸型(不活泼金属的含氧酸盐),pH变小。电解质溶液复原-加阳离子相同的碱或氧化物。
电解意义
使在通常情况下不发生变化的物质发生氧化还原反应,得到所需的化工产品、进行电镀以及冶炼活泼的金属,在金属的保护方面也有一定的用处。
电解工业
氯碱工业
氯碱工业(电解饱和食盐水)制取氯气、氢气、烧碱。
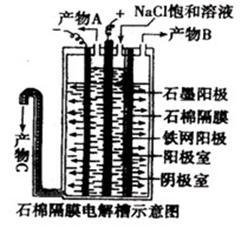
饱和食盐水溶液中存在Na+和Cl-以及水电离产生的H+和OH-。
其中氧化性H+>Na+,还原性Cl->OH-。所以H+和Cl-先放电(即发生还原或氧化反应)。
阴极:2H++2e-=H2↑(还原反应)
阳极:2Cl--2e-=Cl2↑(氧化反应)
总反应的化学方程式:2NaCl+2H2O=(等号上为通电)2NaOH+H2↑+Cl2↑
用离子方程式表示:2Cl-+2H2O=(等号上为通电)2OH-+H2↑+Cl2↑。
电镀应用
电镀:应用电解原理在某些金属表面镀上一薄层其他金属或者合金的过程
条件:①镀件做阴极②镀层金属做阳极③电镀液中含镀层金属离子
电镀时,把待镀的金属制品(即镀件)作阴极,镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。
阳极:Mn-e-=Mn+
阴极:Mn++e-=Mn
这样,在直流电的作用下,镀层金属就均匀地覆盖到镀件的表面。同样的道理,用纯铜作阴极,用粗铜作阳极,用CuSO4溶液作电解液。通入直流电,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,从而达到提纯铜的目的。
金属防护
⑴改变金属的内部组织结构合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。如:不锈钢。
⑵在金属表面覆盖保护层。常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法
①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极。
冶炼金属
钠、钙、镁、铝等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到。如电解熔融的氯化钠可以得到金属钠:
阴极:2Na+ +2e- = 2Na
阳极:2Cl- - 2e- =Cl2↑
放电顺序
(1)阳极:与电源的正极相连。
当阳极的电极材料为金属(Pt或Au除外)时,通电后作电极的金属失去电子变成金属离子,溶解到电解质溶液中。
当阳极的电极材料是惰性物质(如Au、Pt或石墨)时,通电后溶液中的阴离子在阳极上失去电子,当溶液中同时存在多种阴离子时,还原性强的离子先失去电子发生氧化反应。
常见阴离子的还原性由强到弱的顺序是:活性电极>S2->I->Br->Cl->OH->含氧酸根离子(如SO42-、NO3-等)>F-。
Cl-和OH-在电解时的电极反应式分别是:2Cl-―2e-=Cl2↑
4OH-―4e-=2H2O+O2↑
因为水电离能够产生OH-,所以电解含氧酸盐溶液时,在阳极上是OH-放电生成氧气,而含氧酸根离子不发生变化。(当阳极为惰性金属常用的为C、铂、金时,自身放电)
 如图
如图 (2)阴极:与电源的负极相连。在阴极上发生还原反应的是溶液中的阳离子。
当溶液中存在多种阳离子时,按金属活动性顺序,越不活泼的金属,其阳离子的氧化性越强,越容易被还原。在水溶液中,铝之前的金属的阳离子不可能被还原。
电解规律
注意事项
- 无氧酸是其本身的电解
- 含氧酸是水的电解
- 可溶性碱是水的电解
- 活泼性金属的含氧酸盐也是水的电解
- 活泼金属的无氧盐阴极析出氢气并伴随溶液显碱性,阳极析出非金属单质
- 不活泼金属的无氧盐是该盐的电解
- 中等活动性金属的含氧酸盐阴极析出金属,阳极得到氧气同时酸性提高
记忆方法
阳极出氧卤,阴极氢金属。
盐的离子都放电,离子浓度急速减;
盐的离子不放电,水耗离子浓度添。
酸根离子单放电,产物必得卤氢碱;
金属离子单放电,产物必得含氧酸。