甲烷燃料电池
甲烷燃料电池是化学电池中的氧化还原电池。燃料电池是燃料和氧化剂(一般是氧气)在电极附近参与原电池反应的化学电源。
- 中文名 甲烷燃料电池
- 可使用燃料 纯氢气、甲醇、乙醇、天然气
- 主要原料 沼气CH4
- 原理 化学反应
转子间接
甲烷(CH4)燃料电池就是用沼气(主要成分为CH4)作为燃料的电池,与氧化剂O2反应生成CO2和H2O.反应中得失电子就可产生电流从而发电。美国科学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池。燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢为燃料,而氢既不易制取又难以储存,导致燃料电池成本居高不下。
科研人员曾尝试用便宜的碳氢化合物为燃料,但化学反应产生的残渣很容易积聚在镍制的电池正极上,导致断路。美国科学家使用铜和陶瓷的混合物制造电池正极,解决了残渣积聚问题。这种新电池能使用甲烷、乙烷、甲苯、丁烯、丁烷等5种物质作为燃料。
反应方程式
碱性介质下的甲烷燃料电池
负极:CH4+10OH - 8e===CO3 +7H2O
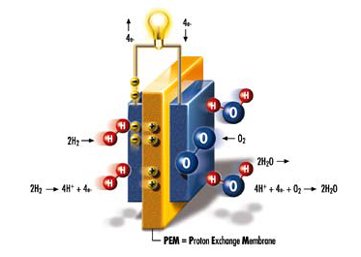 甲烷燃料电池
甲烷燃料电池 正极:2O2+8e+4H2O===8OH
总反应方程式为:CH4+2O2+2OH-===CO32-+3H2O
酸性介质下的甲烷燃料电池
负极:CH4-8e-+2H2O===CO2+8H+
正极:2O2+8e-+8H+===4H2O
总反应方程式为:2O2+CH4===2H2O+CO2
反应情况:
1.随着电池不断放电,电解质溶液的酸性减小;
2.通常情况下,甲烷燃料电池的能量率大于甲烷燃烧的能量利用率。
甲烷燃料电池化学方程式
CH4+2O2+2OH-==CO32-+3H20
①就是CH4在O2中燃烧,生成的CO2和OH-反应生成CO32-
正极在碱性条件下的反应一定是:O2+4e-+2H2O==4OH-
②将总反应式减去正极反应式得到负极反应式,并将O2消去
将总反应式减去正极反应式得到CH4-8e--4H2O+2OH-==CO32-+3H2O-8OH-
移项得到负极反应式:CH4+10OH--8e-==CO32-+7H20
应用历史
历史
燃料电池(Fuel cell),是一种使用燃料进行化学反应产生电力的装置,最早于1839年由英国的Grove所发明。最常见是以氢氧为燃料的质子交换膜燃料电池,由于燃料价格便宜,加上对人体无化学危险、对环境无害,发电后产生纯水和热,1960年代应用在美国军方,后于1965年应用于美国双子星座计划双子星座5号飞船。现在也有一些笔记型电脑开始研究使用燃料电池。但由于产生的电量太小,且无法瞬间提供大量电能,只能用于平稳供电上。
发展前景
燃料电池是一个电池本体与燃料箱组合而成的动力机制。燃料的选择性非常多,包括纯氢气(H2)、甲醇(CH3OH)、乙醇(CH3CH2OH)、天然气,甚至于现在运用最广泛的汽油,都可以作为燃料电池的燃料。这是目前其他所有动力来源无法做到的。而以燃料电池做为汽车的动力,已被公认是二十一世纪必然的趋势。
燃料电池则是以具有可燃性的燃料与氧反应产生电力;通常可燃性燃料如瓦斯、汽油、甲烷(CH4)、乙醇(酒精)、氢等这些可燃性物质都要经过燃烧加热水使水沸腾,而使水蒸气推动涡轮发电,以这种转换方式大部分的能量通常都转为无用的热能,转换效率通常只有约30%,相当的低,而燃料电池是以特殊催化剂使燃料与氧发生反应产生二氧化碳(CO2)和水(H2O),因不需推动涡轮等发电器具,也不需将水加热至水蒸气再经散热变回水,所以能量转换效率高达70%左右,足足比一般发电方法高出了约40%;优点还不只如此,二氧化碳排放量比一般方法低许多,水又是无害的产生物,是一种低污染性的能源。
甲烷做燃料电池电极方程式溶液
甲烷燃料电池的电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:
CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。
负极:CH4 – 8e- + 10OH- == CO32- +7H2O,
正极:2O2 + 4H2O + 8e- = 8OH-