理想气体状态方程

理想气体状态方程(又称理想气体定律、普适气体定律)是描述理想气体在处于平衡态时,压强、体积、物质的量、温度间关系的状态方程。
它建立在玻意耳-马略特定律、查理定律、盖-吕萨克定律等经验定律上。其方程为pV = nRT=mRT/M。这个方程有4个变量:p是指理想气体的压强,V为理想气体的体积,n表示气体物质的量,而T则表示理想气体的热力学温度;还有一个常量:R为理想气体常数。可以看出,此方程的变量很多。
- 中文名 理想气体状态方程
- 外文名 equation of state of ideal gas
- 别称 理想气体定律
- 表达式 pV=(mRT/M)=nRT
- 提出时间 1834
基本概念
理想气体状态方程,也称理想气体定律,描述理想气体状态变化规律的方程。质量为m,摩尔质量为M的理想气体,
其状态参量压强p、体积V和绝对温度T之间的函数关系为: pV=mRT/M=nRT。
p为气体压强,单位Pa。V为气体体积,单位m3。n为气体的物质的量,单位为mol。T为体系温度,单位K。R是气体常量(比例常数)单位是J/(mol·K)。
对于混合理想气体,其压强p是各组成部分的分压强p1、 p2、……之和,故pV=( p1+ p2+……)V=(n1+n2+……)RT,式中n1、n2、……是各组成部分的物质的量。
以上两式是理想气体和混合理想气体的状态方程,可由理想气体严格遵循的气体实验定律得出,也可根据理想气体的微观模型,由气体动理论导出。在压强为几个大气压以下时,各种实际气体近似遵循理想气体状态方程,压强越低,符合越好,在压强趋于零的极限下,严格遵循。
理想气体状态方程是由研究低压下气体的行为导出的。但各气体在适用理想气体状态方程时多少有些偏差;压力越低,偏差越小,在极低压力下理想气体状态方程可较准确地描述气体的行为。极低的压力意味着分子之间的距离非常大,此时分子之间的相互作用非常小;又意味着分子本身所占的体积与此时气体所具有的非常大的体积相比可忽略不计,因而分子可近似被看作是没有体积的质点。于是从极低压力气体的行为触发,抽象提出理想气体的概念。
理想气体在微观上具有分子之间无互相作用力和分子本身不占有体积的特征。
基本公式
pV=nRT
p为气体压强,单位Pa。V为气体体积,单位m3。n为气体的物质的量,单位mol,T为体系温度,单位K。
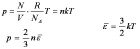 理想气体状态方程
理想气体状态方程 R为比例系数,不同状况下数值有所不同,单位是J/(mol·K)
在摩尔表示的状态方程中,R为比例常数,对任意理想气体而言,R是一定的,约为8.31441±0.00026J/(mol·K)。
如果采用质量表示状态方程,pV=mrT,此时r是和气体种类有关系的,r=R/M,M为此气体的平均摩尔质量
用密度表示该关系:pM=ρRT(M为摩尔质量,ρ为密度)
主要应用
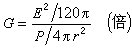 理想气体状态方程
理想气体状态方程 计算气体所含物质的量
从数学上说,当一个方程中只含有1个未知量时,就可以计算出这个未知量。因此,在压强、体积、温度和所含物质的量这4个量中,只要知道其中的3个量即可算出第四个量。这个方程根据需要计算的目标不同,可以转换为下面4个等效的公式:
求压力: p=nRT/v
求体积: v=nRT/p
求所含物质的量:n=pv/RT
求温度:T=pv/nR
化学平衡问题
根据理想气体状态方程可以用于计算气体反应的化学平衡问题。
根据理想气体状态方程可以得到如下推论:
温度、体积恒定时,气体压强之比与所含物质的量的比相同,即可得Ρ平/P始=n平/n始
温度、压力恒定时,气体体积比与气体所含物质量的比相同,即V平/V始=n平/n始
通过结合化学反应的方程,很容易得到化学反应达到平衡状态后制定物质的转化率。
其他资料
推导经验定律
(1)玻意耳定律(玻—马定律)
当n,T一定时 V,p成反比,即V∝(1/p)①
(2)查理定律
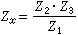 理想气体状态方程
理想气体状态方程 当n,V一定时 p,T成正比,即p∝T ②
(3)盖-吕萨克定律
当n,p一定时 V,T成正比,即V∝T ③
(4)阿伏伽德罗定律
当T,p一定时 V,n成正比,即V∝n ④
由①②③④得
V∝(nT/p) ⑤
将⑤加上比例系数R得
V=(nRT)/p 即pV=nRT
实际气体中的问题当理想气体状态方程运用于实际气体时会有所偏差,因为理想气体的基本假设在实际气体中并不成立。如实验测定1 mol乙炔在20℃、101kPa时,体积为24.1 dm,,而同样在20℃时,在842 kPa下,体积为0.114 dm,,它们相差很多,这是因为,它不是理想气体所致。
一般来说,沸点低的气体在较高的温度和较低的压力时,更接近理想气体,如氧气的沸点为-183℃、氢气沸点为-253℃,它们在常温常压下摩尔体积与理想值仅相差0.1%左右,而二氧化硫的沸点为-10℃,在常温常压下摩尔体积与理想值的相差达到了2.4%。
应用一定量处于平衡态的气体,其状态由p、V和T刻划,表达这几个量之间的关系的方程称之为气体的状态方程,不同的气体有不同的状态方程。但真实气体的方程通常十分复杂,而理想气体的状态方程具有非常简单的形式。
 理想气体状态方程
理想气体状态方程 虽然完全理想的气体并不可能存在,但许多实际气体,特别是那些不容易液化、凝华的气体(如氦、氢气、氧气、氮气等,由于氦气不但体积小、互相之间作用力小、也是所有气体中最难液化的,因此它是所有气体中最接近理想气体的气体。)在常温常压下的性质已经十分接近于理想气体。
此外,有时只需要粗略估算一些数据,使用这个方程会使计算变得方便很多。
注释
几个参数为:
p为理想气体的压强,单位通常为atm或kPa;
V为理想气体的体积,单位为L或称dm3;
n为理想气体中气体物质的量,单位为mol;
R为理想气体常数、普适气体恒量,更多值参见理想气体常数; R=NK(N为阿伏伽德罗常数,Avgadro's number;K为玻尔兹曼常数,Boltzman number)
T为理想气体的绝对温度,单位为K
^ 在所有气体当中,氦气是构成粒子中最小的,氢气仅次之。
^ 氦还是唯一不能在标准大气压下固化的物质。
^ 约合739mm
^ atm为标准大气压,1atm=101.3 kPa
^ 当时查理认为是膨胀1/267,1847年法国化学家雷诺将其修正为1/273.15。
^ 其实查理早就发现压力与温度的关系,只是当时未发表,也未被人注意。直到盖-吕萨克重新提出后,才受到重视。早年都称“查理定律”,但为表彰盖-吕萨克的贡献而称为“查理-盖吕萨克定律”。
^ 如二氧化碳在40℃、52 MPa时,Z≈1.0