熵变
对于化学反应而言,若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变。
当反应进度为单位反应进度时,反应的标准熵变为该反应的标准摩尔熵变,以△rSm表示。
- 中文名 熵变
- 外文名 entropy change;
熵变概述
单位概述
1、熵:体系混乱度(或无序度)的量度。S表示熵。也表示黑洞中不可用热量与其温度的比值。
2. 热力学第三定律:对于纯物质的晶体,在热力学零度时,熵为零。
3. 标准熵:1 mol物质在标准状态下所计算出的标准熵值,用STP表示,单位:J·mol-1 ·K-1
4. 熵的规律:
(1) 同一物质,气态熵大于液态熵,液态熵大于固态熵; ST q(g) > ST q(l) > ST q(s)
S q H2O (g) > H2O (l) > H2O (s)
(2) 相同原子组成的分子中,分子中原子数目越多,熵值越大;
S q O2 (g) < S q O3 (g)
S q NO (g) < S q NO2 (g) < S q N2O4 (g)
S q CH2=CH2 (g) < S q CH3-CH3 (g)
(3) 相同元素的原子组成的分子中,分子量越大,熵值越大;
S q CH3Cl(g) < S q CH2Cl2 (g) < S q CHCl3(g)
(4) 同一类物质,摩尔质量越大,结构越复杂,熵值越大;
S qCuSO4(s) < S qCuSO4·H2O(s) < SqCuSO4·3H2O(s) < SqCuSO4·5H2O (s)
S qF2(g) < S qCl2(g) < S qBr2(g) < SqI2 (g)
(5) 固体或液体溶于水时,熵值增大,气体溶于水时,熵值减少;
计算公式
1. 反应熵变的计算公式
一般地,对于反应:m A + n B =x C + y D
DrSmq = åSq,(生成物) - åSq,(反应物)
= [x Sq,C + y Sq,D] – [m Sq,A + n Sq,B]
6.热力学第二定律:
孤立体系(绝热体系)的自发过程是体系熵增加的过程,即:
状态I ® 状态II, SII > SI DS = SII - SI > 0
DS > 0,过程自发进行;
DS < 0,逆过程自发进行;
DS = 0,平衡状态
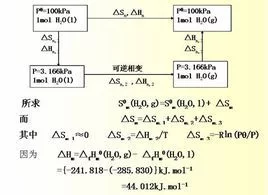
化学反应的标准摩尔熵变
对于化学反应而言,若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变。当反应进度为单位反应进度时,反应的标准熵变为该反应的标准摩尔熵变,以△rSm表示。与反应的标准焓变的计算相似,化学反应的标准摩尔熵变,可由生成物与反应物的标准熵求得。对于反应aA+Bb=eE+dD,有
△rSm一=(eSm一+dHm一)-(aHm一+bHm一)
例3、计算反应203=302在298K时的△rSm一。
【解】查表得Sm=205.1Jmol-1K-1
Sm=238.9Jmol-1K-1
△rSm一=3Sm-2Sm=3�205.1-2�238.9=137.5Jmol-1K-1
答该反应的标准摩尔熵变为137.5Jmol-1K-1
熵变和反应方向
对于孤立体系而言,在其中发生的任何反应变化必然是自发的。热力学第二定律告诉我们:在孤立体系中发生的任何变化或化学反应,总是向着熵值增大的方向进行,即向着△S孤立0的方向进行的。而当达到平衡时△S孤立=0,此时熵值达到最大。
假如不是孤立体系,则可以把体系与其四周的环境一起作为一个新的孤立体系考虑,熵增原理仍然是适用的。由此可以得出,自发反应是向着0的方向进行的。大家知道,在常压下,当温度低于273K时,水会自发地结成冰。这个过程中体系的熵是减小的,似乎违反了熵增原理。但应注重到,这个体系并非孤立体系。在体系和环境间发生了热交换。从水变成冰的过程中体系放热给环境。环境吸热后熵值增大了,而且环境熵值的增加超过了体系熵值的减小。因而体系的熵变加上环境的熵变仍是大于零的,所以上述自发反应是符合热力学第二定律的。
熵的影响因素
1) 熵与物态有关:
对同一物质,其固态的熵值小于液态的熵小于气态的熵,即S固<S液<S气.
2) 熵与分子的组成有关:
对不同的物质,其组成分子越复杂,熵就越小.而简单分子的熵值一般较大.
3) 熵与体系物质的量n有关:
体系的n值越大,其熵值越大.
4) 熵与温度有关:
熵随着体系温度的升高而增大.
5) 熵与压力有关:
随着体系压力的加大,熵值减小.因为压力加大,体系的有序程度加大,则熵就减小.
2. 化学反应熵变的大小
1) 熵变(ΔS)与体系中反应前后物质的量的变化值有关:
a. 对有气体参加的反应:
主要看反应前后气体物质的量的变化值即Δn(g),Δn(g)正值越大,反应后熵增加越大;Δn(g)负值越大,反应后熵减越多;
 熵变
熵变 b. 对没有气体参加的反应:
主要看各物质总的物质的量的变化值即Δn(总),Δn(总)正值越大,熵变正值越大;Δn(总)负值绝对值越大,熵变也是负值的绝对值越大,但总的来说熵变在数值上都不是特别大.
2) 熵变(ΔS)值随温度的改变变化不大,一般可不考虑温度对反应熵变(ΔS)的影响.
3) 熵变(ΔS)值随压力的改变变化也不大,所以可不考虑压力对反应熵变的影响.