氯化铯
氯化铯,制取金属铯和含铯单晶的原料;分析试剂;用于制备导电玻璃;用于通过密度梯度离心方法制备从DNA中分离RNA的溶液。
- 中文名 氯化铯
- 外文名 Cesium chloride
- 化学式 CsCl
- 相对分子质量 168.36
分子结构
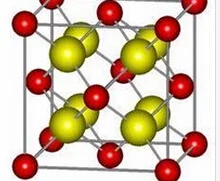
 分子结构图
分子结构图 晶胞结构
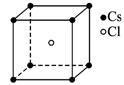 氯化铯晶胞
氯化铯晶胞 低于445℃,氯化铯晶胞是素晶胞(可看成氯离子作简单立方堆积,铯离子填充立方空隙)。采取这种晶体结构的化合物包括CsCl,CsBr,CsI,TlCl,TlBr和NH4Cl等。高于445℃,氯化铯也具有配位数6的面心立方结构[见三师大合编,潘道皑等编《物质结构》第二版,高教社,1989:545]。
基本信息
中文名称:氯化铯
英文名称:Cesium chloride
别名:皮萨草
更多名称:Pisa grass
CAS号:7647-17-8
分子式:CsCl
分子量:168.3585
物性数据
1.性状:无色结晶,属立方晶系。有吸湿性。
2.密度(g/mL,25/4℃):3.983.相对蒸汽密度(g/mL,空气=1):未确定4.熔点(ºC):645 ºC5.沸点(ºC,常压):1300 ºC6.沸点(ºC,5.2kPa):未确定7.折射率:1.64188.闪点(ºC):13039.比旋光度(º):未确定10.自燃点或引燃温度(ºC):未确定11.蒸气压(kPa,25ºC):未确定12.饱和蒸气压(kPa,60ºC):未确定13.燃烧热(KJ/mol):未确定14.临界温度(ºC):未确定15.临界压力(KPa):未确定16.油水(辛醇/水)分配系数的对数值:未确定17.爆炸上限(%,V/V):未确定18.爆炸下限(%,V/V):未确定19.溶解性:极易溶于水[100克H2O中162克(0℃),259克(90℃)]。易溶于乙醇、甲醇,不溶于丙酮。在20℃水中:1860g/L
存储方法
库房低温通风干燥。
合成方法
1.将碳酸铯溶解于少量水中。在不断搅拌下慢慢加入相对密度为1.18的盐酸,加热反应:
当pH=3时,煮沸半小时加入氢氧化铯使溶液pH值到中性。过滤,滤液蒸发浓缩至大量结晶析出,冷至室温,分离母液,洁净与100ºC烘干,即为成品。
2.用碳酸铯溶于盐酸,再浓缩其溶液以制取氯化铯。通常可得到纯度为99.5%的氯化铯,可直接使用。对不够纯净的氯化铯,可采用下列方法精制。将15g的氯化铯,加热溶于100mL的水中。将化学计量24.2g氯化汞溶于25mL 4mol的盐酸中。趁热将此HgCl2HCl溶液加到上述溶液中,搅拌混合,冷却,即可析出CsHgCl3结晶。吸滤,收集结晶,弃去母液。将结晶溶于120mL的热水中,冷却后再次有结晶析出。为此反复进行2~3次重结晶,碱金属可降至0.01%以下,最后将结晶溶于热水,通入H2S气体使溶液达到饱和,就有HgS沉淀析出,滤去HgS,收集滤液,蒸发至干,即可得纯净的氯化铯。
3.通常可得到纯度为995%的氯化铯,可直接使用。对不够纯净的氯化铯,可采用下列方法精制。
精制方法1[166]将15g的氯化铯,加热溶于100mL的水中。将化学计量24.2g氯化汞溶于25mL 4mol的盐酸中。趁热将此HgCl2、HCl溶液加到上述溶液中,搅拌混合,冷却,即可析出CsHgCl3结晶。吸滤,收集结晶,弃去母液。将结晶溶于120mL的热水中,冷却后再次有结晶析出。为此反复进行2~3次重结晶,碱金属可降至0.01%以下,最后将结晶溶于热水,通入H2S气体使溶液达到饱和,就有HgS沉淀析出,滤去HgS,收集滤液,蒸发至干,即可得纯净的氯化铯。
主要用途
1.用作分析试剂,如作显微镜分析、光谱分析试剂。还用于医药工业、铯盐制造、X射线荧光屏和光电管材料。2.气相色谱固定液,用于三价铬和镓的点滴分析、二联苯和三联苯的高温色谱分析。用于制取金属铯、铯盐和及作为铯单晶的原料。
安全信息
风险术语
R68:Possible risk of irreversible effects. 可能有不可逆后果的危险。
安全术语
S36/37:Wear suitable protective clothing and gloves.穿戴适当的防护服和手套。
系统编号
CAS号:7647-17-8
MDL号:MFCD00134037
EINECS号:231-600-2
RTECS号:FK9625000
毒理学数据
1.急性毒性:LD50:2306mg/Kg(大鼠经口);2004mg/Kg(兔经皮)。
2.可因吸入、咽下或皮肤吸收而危害健康
生态学数据
氯化铯在原子能工业中和氯化钚配对,熔盐电解制备金属钚。氯化铯溶液在生物研究上广泛用于离心分离病毒和其他分子。很稀的氯化铯能提高乙酰胆碱酯酶的活性。
性质与稳定性
易潮解。不溶于水,也不溶于乙醇和丙酮中。