氧化还原反应
《氧化还原反应(初高中的衔接)》是天津市卓群中学提供的微课课程,主讲教师为石岩霞。
- 中文名称 氧化还原反应(初高中的衔接)
- 提供学校 天津市卓群中学
- 主讲教师 石岩霞
- 类别 微课
反应实质
1.发生了电子的转移。(即在离子化合物中是电子的得失,在共价化合物里是电子的偏移。在反应物之间电子
发生转移的反应,又称为氧化还原反应)。 1(1)氧化还原反应不一定是得失氧原子,而是任何降低价态或升高价态的任何元素都可以成为氧化或还原(反应)。
某物质中的任何元素失去电子(即化合价升高)的反应叫氧化反应/有元素化合价降低(得电子)的反应叫还原反应,既得电子又失电子的反应叫氧化还原反应
2.强弱律:反应中满足:氧化性:氧化剂>氧化产物
 氧化还原反应(原电池中的氧化还原)
氧化还原反应(原电池中的氧化还原) 还原性:还原剂>还原产物>氧化产物
3.价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
4.不交叉原则:同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多只能达到同种价态
5.强则优先原则:在同一氧化还原反应中,氧化剂遇多种还原剂时,先和最强还原剂反应
6. 归中律:不同价态的同种元素,其较高价态与较低价态均转化为中间价态,不得交错升降。
还原剂 + 氧化剂 ---> 氧化产物 + 还原产物
 氧化还原反应中各物质关系
氧化还原反应中各物质关系 一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。
总结:氧化剂发生还原反应,得电子,化合价降低,有氧化性,被还原,生成还原产物。
还原剂发生氧化反应,失电子,化合价升高,有还原性,被氧化,生成氧化产物。
注意(此处以氧原子为例)
口诀:升失氧还,降得还氧
相关范例
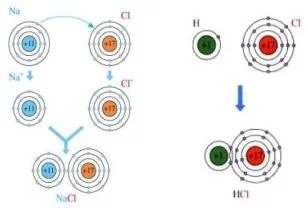
范例——氢气与氯气
氢气与氯气的化合反应,其总反应式如下:
H₂+Cl2=2HCl我们可以把它写成两个半反应的形式:
 氧化还原反应方程式
氧化还原反应方程式 氧化反应:
H2 - 2e⁻ → 2H+
还原反应:
Cl2 + 2e- → 2Cl⁻
单质总为0价。第1个半反应中,氢元素从0价被氧化到+1价;同时,在第2个半反应中,氯元素从0价被还原到-1价。 (本段中,“价”指氧化数)
两个半反应加合,电子数消掉:
H2 → 2H+ + 2e-
2e- + Cl2 → 2Cl-
H2 + Cl2 → 2H+ + 2Cl-
最后,离子结合,形成氯化氢:
H2 + Cl2 → 2HCl
范例——碳与硝酸
写出反应物和生成物的化学式
C + HNO3→ NO2 + CO2 + H2O
列出元素的化合价的变化
在反应物这边 在生成物这边 变化量
C化合价 0 +4 升高4
N化合价 +5 +4 降低1
使化合价的升高和降低的总数相等
C + 4HNO3→ 4NO2 + CO2 + H2O
配平其它物质的系数
C + 4HNO3 = 4 NO2↑ + CO2↑ + 2 H2O
范例——工业炼铁
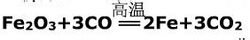 一氧化碳还原氧化铁
一氧化碳还原氧化铁 这个反应中,三氧化二铁是氧化剂,而一氧化碳是大家熟悉的还原剂.三氧化二铁中的氧元素给了一氧化碳,使后者氧元素含量增加变为二氧化碳。铁由3价变为单质0价(降低,为氧化剂),而碳由2价变为4价(升高,为还原剂)
范例——复分解反应
另外,复分解反应一定不是氧化还原反应.因为复分解反应中各元素的化合价都没有变化。例如:
Na2CO3+CaCl2=2NaCl+CaCO3↓其中钠元素保持1价,碳酸根保持-2价,氯元素保持-1价,而钙元素保持2价.
配平方法
配平方法——得失电子守恒法
1.配平原理
发生氧化还原反应时,还原剂失去电子、氧化剂得到电子。因为整个过程的本质好比是还原剂把电子给了氧化剂,在这一失一得之间,电子守恒。故根据还原剂失去电子的数目和氧化剂得到电子的数目相等,结合二者化合价的改变情况,可以分别把氧化剂、还原剂的计量数计算出来,这样整个氧化还原反应就顺利配平了。
2.方法和步骤
①标出发生变化的元素的化合价,并确定氧化还原反应的配平方向。
在配平时,需要确定先写方程式那边物质的计量数。有时先写出方程式左边反应物的计量数,有时先写出方程式右边生成物的计量数。一般遵循这样的原则:
自身氧化还原反应→ 先配平反应物的计量数;
部分氧化还原反应 → 先配平生成物的计量数;
一般的氧化还原反应→既可先配平生成物的计量数,也可先配平反应物的计量数。
②列出化合价升降的变化情况。当升高或降低的元素不止一种时,需要根据不同元素的原子个数比,将化合价变化的数值进行叠加。
③根据电子守恒配平化合价变化的物质的计量数。
④根据质量守恒配平剩余物质的计量数。最终并根据质量守恒检查配平无误。
配平方法——离子/电子法
在水溶液中进行的氧化还原反应,除用化合价升降法配平外,一般常用离子/电子法配平。其配平原则是:反应过程中,氧化剂获得的电子总数等于还原剂失去的电子总数。现在结合以下实例说明其配平步骤。
在酸性介质中,KMnO4与K2SO3反应生成MnSO4和K2SO4,配平此化学方程式。
配平的具体步骤如下:
(1)根据反应写出未配平的离子方程式
MnO4+ SO3→ Mn+ SO4①
(2)写出两个半反应式,一个表示还原剂被氧化的反应,另一个表示氧化剂被还原的反应:
氧化反应 SO3→ SO4
式中产物的氧原子数较反应物中的多,反应又在酸性介质中进行,所以可在上式反应物中加H2O,生成物中加H,然后进行各元素原子数及电荷数的配平,可得:
SO3+ H2O → SO4+ 2H+ 2e- ②
还原反应 MnO4→Mn
式中产物中的氧原子数减少,应加足够多的氢离子(氧原子减少数的2倍),使它结合为水,配平后则得:
MnO4+ 8H+5e- → Mn+ 4H2O ③
(3)根据氧化剂和还原剂得失电子数相等的原则,在两个半反应式中各乘以适当的系数
即以②×5,③×2,然后相加得到一个配平的离子方程式。
(4)写出完全的反应方程式:
5K2SO3 + 2KMnO4 + 3H2SO4=6K2SO4 + 2MnSO4 + 3H2O
化合价升降法是一种适用范围较广的配平氧化还原反应方程式的方法。离子?电子法虽然仅适用于溶液中离子方程式的配平,但它避免了化合价的计算。在水溶液中进行的较复杂的氧化还原反应,一般均用离子-电子法配平。这两种配平方法可以相互补充。
配平方法——待定系数法
1.配平原理
质量守恒定律告诉我们,在发生化学反应时,反应体系的各个物质的每一种元素的原子在反应前后个数相等。通过设出未知数(如x、y、z等均大于零)把所有物质的计量数配平,再根据每一种元素的原子个数前后相等列出方程式,解方程式(组)。计量数有相同的未知数,可以通过约分约掉。
2.方法和步骤
对于氧化还原反应,先把元素化合价变化较多的物质的计量数用未知数表示出来,再利用质量守恒把其他物质的计量数也配平出来,最终每一个物质的计量数都配平出来后,根据某些元素的守恒,列方程解答。
快速配平七步法:
步骤一:分析化合价升降
步骤二:交换升降价数的系数
步骤三:过桥(双线桥)
步骤四:找到没有参加氧化还原反应的元素,并加入系数中。除(氧、氢)
步骤五:配平氢
步骤六:检查氧是否平
步骤七:完善(加反应条件、加等号、加上下箭头、约公约数)
配平方法——化合价升降法
例子:
1,写出反应物和生成物的化学式
C + HNO3→ NO2 + CO2 + H2O
2,列出元素的化合价的变化
在反应物这边 在生成物这边 变化量
C化合价 0 +4 升高4
N化合价 +5 +4 降低1
3,使化合价的升高和降低的总数相等
C + 4HNO3→ 4NO2 + CO2 + H2O
4,配平其它物质的系数
C + 4HNO3 = 4 NO2↑ + CO2↑ + 2 H2O
注意事项
1:“集合原子”应做到优先配平。
2:先拆后合的拆项配平法中,需要拆的项是那些在反应中化合价既升高又降低(既作氧化剂又作还原剂)的物质。
3:整体法配平法中,选择把哪几个化合价升降过程“捆绑”作为一个过程是关键,选择时一定要把在反应中存在固定物质的量之比的升降过程过程进行“捆绑”,不存在固定物质的量之比的升降过程就不能进行“捆绑”。如S+KNO3+C——K2S+CO2+N2
4:离子反应配平:关键在于能否充分利用“电荷守恒”
5:缺项配平:注意两点:★如果是化学反应方程式其缺项一般为:水、酸、碱。如果是离子反应方程式其缺项般为:水、H、OH。★在离子反应方程式配平其缺项时如有两种可能如(H2O、H)或(H2O、OH),还应考虑离子共存的问题如:
Cu(2+)+FeS2+囗____——Cu2S+SO4(2-)+Fe(2+)+囗____
可有两种选择:(14.5.12H2O、7.3.5.24H+)或(14.5.24OH-、7.3.5.12H2O)后一种配平由于OH与Cu不能共存所以不正确。
6:在氧化还原反应中,并不是所有元素的化合价都发生改变,故并不是所有元素都发生氧化还原反应。
7:并非只有得氧、失氧的反应才是氧化还原反应。
规律
氧化还原反应中,存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态 。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。
守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
例题
解题方法:氧化剂得到电子化合价降低转变为还原产物,还原剂失去电子化合价升高转变为氧化产物。在同一个氧化还原反应中得失电子数相等,即化合价升高总价数等于化合价降低总价数。
【例题1】(NH4)2SO4在强热条件下分解,生成NH3、SO2、N2、H2O,反应中生成的氧化产物和还原产物的物质的量之比为
A. 1 : 3 B. 2 : 3 C. 1 : 1 D. 4 : 3
解析:(NH4)2SO4在强热条件下分解,氧化产物为N2,还原产物为SO2,依据化合价升降相等原则有3×2↑×x = 2↓×y,故有x : y = 1 : 3
答案:A
【例题2】R2O8n-在一定条件下可把Mn2+氧化为MnO4-,若反应中R2O8n-变为RO42-,又知反应中氧化剂与还原剂物质的量之比为5:2,则n值为:
A. 4 B. 3 C. 2 D. 1
解析:依题意有5R2O8n- + 2Mn2+ === 2MnO4- + 10RO42-,设R2O8n-中R的化合价为x,依据化合价升降相等原则有
5×2×↓(x-6) = 2×↑(7-2),解得x = 7,因此有
2×7 + 8×(-2) = -n,解得n = 2.
答案:C
【例题3】(NH4)2PtCl6在强热条件下分解,生成N2、HCl、NH4Cl、Pt反应中氧化产物与还原产物的物质的量之比为
A. 1 : 2 B. 1 : 3 C. 2 : 3 D. 3 : 2
解析:(NH4)2PtCl6在强热条件下分解,氧化产物为N2,还原产物为Pt,依据化合价升降相等原则有3×2↑×x = 4↓×y,故有x : y = 2 : 3
答案:C
【例题4】Cl2与NaOH(70℃)的溶液中,能同时发生两个自身氧化还原反应,完全反应后,测得溶液中NaClO、NaClO3之比4 : 1,则溶液中NaCl和NaClO的物质的量之比为
A. 11:2 B. 1:1 C. 9:4 D. 5:1
解析:Cl2中氯元素的化合价为0价,而在NaClO、NaClO3中氯元素的化合价分别为+1、+5价,设NaCl和NaClO的物质的量分别为x和y,依据化合价升降相等原则有1↓×x = 1↑×y + 5↑××y,故有x : y = 9 : 4
答案:C
【例题5】含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n : m可能是①5 : 1、②9 : 2、③3 : 1、④2 : 1、⑤4 : 1
A. ②③⑤ B. ①③④ C. ②③④ D. ①③ 解析:当Fe恰好完全转变为+2价时,3Fe + 8HNO3 === 3Fe(NO3)2 + 2NO↑+ 4H2O,有 = 解得:n : m = 3 : 1
当Fe恰好完全转变为+3价时,Fe + 4HNO3 === Fe(NO3)3 + NO↑+ 2H2O,有
= 解得:n : m = 9 : 2
结合选项分析n : m的取值范围在4.5至3之间。
答案:A
【例题6】Zn与HNO3反应,Zn和被还原的HNO3的物质的量之比为4 : 1则HNO3的还原产物可能为
A. NO2 B. NO C. N2O D. NH4NO3
解析:设还原产物中氮元素的化合价为x,依据化合价升降相等原则有
4×2↑=1↓×(5-x) 解得:x = -3
答案:D
【例题7】将Mg和 Cu的合金2.64克,投入适量的稀HNO3中恰好反应,固体全部溶解时,收集的还原产物为NO,体积为0.896L(SPT),向反应后的溶液中加入2mol/L NaOH溶液60mL时,金属离子恰好完全沉淀,则形成沉淀的质量为
A. 4.32克 B. 4.68克 C. 5.36克 D. 6.38克
解析:依据在同一个氧化还原反应中得失电子数相等原则,解得Mg和 Cu共失去
n(e-) = ×3 = 0.12 mol,由电荷守恒知Mg和Cu共需要结合0.12 mol OH-,故形成沉淀的质量m = 2.64g + 0.12 mol×17g/mol = 4.68g
答案:B
【例题8】取x克Mg和 Cu的合金完全溶于浓HNO3中,反应过程中HNO3被还原只产生8960 mL NO2和672 mL N2O4气体(SPT),向反应后的溶液中加入足量的NaOH溶液,形成沉淀质量为17.02克,则X的值为
A. 8.64克 B. 9.20克 C. 9.00克 D. 9.44克 解析:依据在同一个氧化还原反应中得失电子数相等原则,解得Mg和 Cu共失去
n(e-) = ×1 = 0.46 mol,由电荷守恒知Mg和 Cu共需要结合0.46 mol OH-,因此有17.02g= x + 0.46 mol×17g/mol ,解得x = 9.20g
答案:B
【例题9】将14克Ag和Cu的合金与一定浓度的HNO3反应,全部溶解后,产生的气体再通入1.12 L(SPT)O2,恰好完全吸收,求合金中各成分的含量?
解析:Ag和Cu失去电子的总数等于O2得到电子的总数,依题意有
108n(Ag) + 64n(Cu) =14
n(Ag) + 2n(Cu) = ×4 = 0.2
解得n(Ag)= 0.1mol n(Cu)=0.05mol
w(Ag) = ×100% = 77.14%
w(Cu) = 1-77.14% = 22.86%
答案:合金中w(Ag)为77.14%,w(Cu)为 22.86%。
【例题10】将51.2 g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、 N2O4 、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L的NaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为
(已知NO+NO2+2NaOH === 2NaNO2+H2O,2NO2+2NaOH === NaNO3 +NaNO2 +H2O )
A. 0.2 mol B. 0.4 mol C. 0.6 mol D. 0.8 mol
解析:51.2 g Cu即为0.8 mol Cu,失去的电子等于NaNO2 生成时得到的电子,则NaNO2 为0.8 mol,由Na+守恒知:n(Na+) = n(NaNO2)+ n(NaNO3),得NaNO3为0.2 mol。
答案:A
【练习1】9.8g镁、铝混合物溶解在一定量的热浓硝酸中,当金属完全溶解后收集到标准状况下8.96 L NO2和2.24 L N2O4气体,向反应的溶液中加入足量的氨水,则生成的沉淀有
A. 18克 B. 20克 C. 22克 D. 24克
解析:依据在同一个氧化还原反应中得失电子数相等原则,解得Mg和 Al共失去
n(e-)=×1 + ×2 = 0.6 mol。由电荷守恒知Mg和 Al共需要结合0.6 mol OH-,故形成沉淀的质量m = 9.8g + 0.6 mol×17g/mol = 20g
答案:B
将11.2g的Mg和Cu的混合物完全溶解于足量的硝酸中,收集反应产生的气体X,再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀,根据题意推断气体X的成分可能是
A. 0.3mol NO2和0.3mol NO B. 0.2mol NO2和0.1mol N2O4
C. 0.1mol NO、0.2mol NO2和0.05mol N2O4 D. 0.6mol NO
解析:根据Mg、Cu的变化:Mg~Mg2+~2OH-~Mg(OH)2~2e-、Cu~Cu2+~2OH-~Cu(OH)2~2e-知增加的质量为OH-的质量,转移电子的物质的量与OH-的物质的量相等,则有n(OH-)=21.4g-11.2 g/17g·mol-1=0.6 mol,故反应转移的电子的物质的量也为0.6 mol。选项A转移电子的物质的量
为0.3mol×1+ 0.3mol×3 = 1.2 mol,不正确;选项B转移电子的物质的量为0.2mol×1+ 0.1mol×2 = 0.4 mol,不正确;选项C转移电子的物质的量为0.1mol×3+ 0.2mol×1+ 0.05mol×2 = 0.6 mol,正确;选项D转移电子的物质的量为0.6mol×3=1.8 mol,不正确.
答案:C