亚铁氰化钾

亚铁氰化钾别名黄血盐 (Potassium Ferrocyanide),分子式:K4Fe(CN)6·3H2O。为浅黄色单斜体结晶或粉末,无臭,略有咸味,相对密度1.85。常温下稳定,加热至70℃开始失去结晶水,100℃时完全失去结晶水而变为具有吸湿性的白色粉末。高温下发生分解,放出氮气,生成氰化钾和碳化铁。溶于水,不溶于乙醇、乙醚、乙酸甲酯和液氨。其水溶液遇光分解为氢氧化铁,与过量Fe3+反应,生成普鲁士蓝颜料。
- 中文名 亚铁氰化钾
- 外文名 potassiunferrocyanide
- 别名 黄血盐
- 化学式 K4Fe(CN)6·3H2O
- 相对分子质量 422.39
简介
中文名称:亚铁氰化钾
中文别名:黄血盐钾;黄血盐
英文名称:Potassium hexacyanoferrate
英文别名:Ferrate(4-), hexakis(cyano-C)-, tetrapotassium,(OC-6-11)-; Potassium ferrocyanide; Potassium hexacyanoferrate (III) trihydrate; Tetrapotassium hexacyanoferrate; ; tetrapotassium iron(+6) cation hexacyanide; iron(2+) potassium cyanide (1:4:6)
物理性质
CAS:13943-58-3
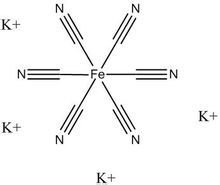 亚铁氰化钾结构式
亚铁氰化钾结构式 外观与性状:柠檬色单斜晶体。
熔点(℃):70(失去全部结晶水)
相对密度(水=1):1.853(17℃)
沸点(℃):无(受热分解)
溶解度表:
温度(℃) | 溶解度(g) |
|---|---|
0 | 12.5 |
| 10 | 17.4 |
20 | 22.0 |
30 | 26.0 |
50 | 32.6 |
70 | 38.2 |
80 | 40.1 |
99.6 | 42.63 |
含量分析:准确称取试样约5g,置于500mL容量瓶中,加水溶解后定容混匀。取该液25mL置于500mL三角瓶中,加(1+8)硫酸液20mL、二苯胺指示液(TS-89)3~5滴、六氰合铁酸三钾液(10g/L)3~5滴,在剧烈搅拌下,用0.03mol/L硫酸锌标准液缓慢滴定至溶液由黄绿色变为紫蓝色终点。
毒性:ADI 0~0.025(以亚铁氰化钠计;FAO/WHO,2001)。因铁与氰基的结合很强,故毒性极低。
溶解性:溶于水,不溶于乙醇、乙醚。
浅黄色单斜结晶或粉末,无臭。在空气中稳定,加热至70℃,开始失去结晶水,100℃时变成吸湿性白色粉末状无水物。
化学性质
经过强烈灼烧分解,放出氮气并生成氰化钾和碳化铁。
性能
具有抗结性能,可用于防止细粉、结晶性食品板结。例如,食盐长久堆放易发生板结,加入亚铁氰化钾后食盐的正六面体结晶转变为星状结晶,从而不易发生结块。
毒性
毒性由于分子中氰离子与铁结合牢固,因此亚铁氰化钾毒性极低。大鼠经口LD50为1.6~3.2g/kg。FAO/WHO(1974)规定,ADI为0~0.25mg/(kg·d)。
制备
1、由氰熔体与硫酸亚铁,氯化钾反应生成亚铁氰化钾钙复盐沉淀,再与纯碱反应脱钙后,与氯化钾反应转化制得。也可用回收氰化钠废液,与氯化钙,硫酸亚铁反应,再与氯化钾反应转化制得。
2、氰熔体法:以生产电石的副产物氰熔体(氰化钙和氰化钠的混合物)为原料。用水在80℃以下萃取(温度过高会发生水解反应),萃取液中按计量加入硫酸亚铁生成氰化亚铁络合物:
4NaCN+4Ca(CN)2+2FeSO4→Na4Fe(CN)6+Ca2Fe(CN)6+2CaSO4↓
经压滤除去硫酸钙沉淀,得络合物混合溶液。在75℃下加入氯化钾产生复盐沉淀:
Ca2Fe(CN)6+2KCl→K2CaFe(CN)6↓+CaCl2
Na4Fe(CN)6+2KCl→K2Na2Fe(CN)6↓+2NaCl 将复盐分离后在脱钙罐内加热至80℃,加入纯碱使其脱钙:
2K2CaFe(CN)6+2Na2CO3→K4Fe(CN)6+Na4Fe(CN)6+2CaCO3↓
压滤除去碳酸钙,在转化罐中加入氯化钾,加热煮沸使钠盐转化为亚铁氰化钾:
反应后除杂质,冷却结晶,离心分离,干燥得成品。
3、复盐法:以氰化钠废液与氯化钙、硫酸亚铁于70~80℃下反应生成亚铁氰化钠和硫酸钙;过滤,滤液于复盐罐中加入氯化钙和氯化钾,于75℃下反应生成亚铁氰化钾钙复盐沉淀。后续工艺与氰熔体法相同。有关反应如下:
6NaCN+FeSO4+CaCl2→Na4Fe(CN)6+CaSO4↓+2NaCl
Na4Fe(CN)6+4KCl→K4Fe(CN)6+4NaCl
应用
1、主要用作钢铁工业的渗碳剂,以提高钢铁制件的表面硬度。印染工业用作氧化助剂,使精元棉布染色逐步进行,保持染色质量。医药工业用作凝聚剂,能达到理想的除杂工艺,提高药品质量。颜料工业用作生产颜料华蓝的主要原料。化学工业用作除铁剂。食品行业用作食品添加剂----食盐抗结剂。
2、亚铁氰化钾可配合乙酸锌作为澄清剂:它是利用乙酸锌[Zn(CH3COO)2·2H2O]与亚铁氰化钾反应生成的氰亚铁酸锌沉淀来挟走或吸附干扰物质。这种澄清剂除蛋白质能力强,但脱色能力差,适用于色泽较浅,蛋白质含量较高的样液的澄清,如乳制品、豆制品等,可以用于可溶性糖类的提取和澄清。
3、作抗结剂,我国规定可用于食盐,最大使用量0.005 g/kg(以亚铁氰根计)。中国GB 2760-96规定,允许作为食盐的抗结剂。最大使用量为0.01g/kg(以亚铁氰根计)。添加于食盐中,用量0.01g/kg(以亚铁氰根计)。具体使用时,可配制成浓度为0.25~0.5g/100mL的水溶液,再喷入100kg食盐中。欧洲常将亚铁氰化钾用作葡萄酒中铁、铜离子去除剂。
4、在欧洲常用于某些葡萄酒,以除去铁、铜。
注意事项
安全术语
1.不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
2.穿戴适当的防护服。
3.戴适当的手套和护目镜或面具。
4.避免与皮肤和眼睛接触。
风险术语
刺激眼睛、呼吸系统和皮肤。
危险性概述
健康危害:该品属低毒类。吸入引起咳嗽、气短。大量口服引起胃肠不适。有资料报道,中毒时肾脏受损害,尿糖大量增加。接触该品多年的工人中,未见发生皮炎。
环境危害:对环境有严重危害。
燃爆危险:该品不燃。
急救措施
皮肤接触:脱去污染的衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:饮足量温水,催吐。就医。
消防措施
危险特性:与硝酸铜、亚硝酸钠加热时发生爆炸。遇高热分解释出高毒烟气。
有害燃烧产物:氰化钾。
灭火方法:尽可能将容器从火场移至空旷处。灭火器种类:雾状水、泡沫、干粉、二氧化碳、砂土。
泄漏应急处理
应急处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿一般作业工作服。不要直接接触泄漏物。
小量泄漏:避免扬尘,小心扫起,运至废物处理场所处置。
大量泄漏:收集回收或运至废物处理场所处置。
操作处置与储存
操作注意事项:密闭操作,全面通风。防止粉尘释放到车间空气中。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿透气型防毒服,戴防化学品手套。避免产生粉尘。避免与硝酸盐接触。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装密封。应与硝酸盐分开存放,切忌混储。储区应备有合适的材料收容泄漏物。