一氧化二氮

一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,是一种氧化剂,化学式N2O,在一定条件下能支持燃烧,但在室温下稳定,有轻微麻醉作用,其麻醉作用于1799年由英国化学家汉弗莱·戴维发现。该气体早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。一氧化二氮能溶于水、乙醇、乙醚及浓硫酸。它也可以用来作为火箭和赛车的氧化剂,以及增加发动机的输出功率。需要注意的是,一氧化二氮是一种强大的温室气体,它的效果是二氧化碳的296倍。
- 中文名 一氧化二氮
- 英文名 Laughing gas;Nitrou oxide
- 别称 笑气,氧化亚氮
- 化学式 N₂O
- 分子量 44.0128
简介
一氧化二氮早期被用于牙科手术的麻醉,是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,产物除N2O外还有水,此反应的化学方程式为 )NH4NO3====N2O↑+2H2O;等电子体理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是直线型,N2O为极性分子。也是一些游戏里面的氮气加速装置。
 一氧化二氮
一氧化二氮 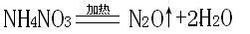 制备方程式
制备方程式 基本信息
中文名称:一氧化二氮。
 一氧化二氮
一氧化二氮 英文名称:Dinitrogen oxide;Laughing gas。
别名:氧化亚氮;笑气。
CAS No.:10028-97-2。
EINECS号 233-271-0
InChI InChI=1/NO/c1-2/q-1
分子式:N2O。
相对分子质量:44.0128
危险标记:5(不燃气体)。
包装方法:钢质气瓶。
分子结构:N=N=O
结构
一氧化二氮的分子是直线型结构。其中一个氮原子与另一个氮原子相连,而第二个氮原子又与氧原子相连。它可以被认为是
和 的共振杂化体。 注意不要将一氧化二氮和其他的氮氧化物混淆,比如二氧化氮NO2和一氧化氮NO。 将一氧化二氮与沸腾汽化的碱金属反应可以生成一系列的亚硝酸盐,在高温下,一氧化二氮也可以氧化有机物。
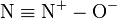 一氧化二氮
一氧化二氮 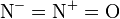 一氧化二氮
一氧化二氮 物理性质
熔点-90.8℃
沸点-88.49℃
临界温度36.5℃
临界压力7.263×10^6Pa
相对密度1.977
折光率1.0005-7265 bar
化学性质
加热硝酸铵可以生成一氧化二氮和水:NH4NO3=N2O↑+2H2O,工业上对硝酸铵热分解可制得纯度95%的一氧化二氮,一个笑气分子与六个水分子结合在一起。当水中溶解大量笑气时,再把水冷却,就会有笑气晶体出现。把晶体加热,笑气会逸出。人们利用笑气这种性质,制高纯笑气。
历史
这种气体是约瑟夫·普利斯特里在1772年发现的。汉弗莱·戴维自己和他的朋友,包括诗人柯尔律治和罗伯特·骚塞在16世纪90年代试验了这种气体。他们发现一氧化二氮能使病人丧失痛觉,而且吸入后仍然可以保持意识,不会神志不清。不久后笑气就被当作麻醉剂使用,尤其在牙医师领域。因为通常牙医师无专职的麻醉师,而诊疗过程中常需要病患保持清醒,并能依命令做出口腔反应,故在此气体给牙医师带来极大的方便。
医学应用
【别名】 笑气,氧化亚氮,
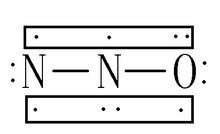 N2O的Lewis电子式
N2O的Lewis电子式 N2O的Lewis电子式
连二次硝酸酐
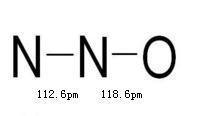 键长
键长 键长
【分子结构】一氧化二氮分子为直线形分子,极性分子。N2O的分子是直线形的(N-N-O),N,O原子采取sp杂化,生成两个σ键,两个三中心四电子π键,N的氧化数为+1。
【英文名称】Nitrous Oxide 西班牙名称: Oxido Nitroso
【医学适应症】 因全麻效果差,目前常与氟烷、甲氧氟烷、乙醚或静脉全麻药合用。现已少用。氧化亚氮(N2O)用于麻醉,对呼吸道无刺激,对心、肺、肝、肾等重要脏器功能无损害。在体内不经任何生物转化或降解,绝大部分仍以原药随呼气排出体外,仅小量由皮肤蒸发,无蓄积作用。吸入体内只需要30s~40s 即产生镇痛作用,镇痛作用强而麻醉作用弱,受术者处于清醒状态(而不是麻醉状态),避免了全身麻醉并发症,手术后恢复快。
【医学上用量用法】 吸入:用量视手术需要和病人情况而定。
【医学上注意事项】 1.大手术需配合硫喷妥钠及肌肉松弛剂等;吸入气体中氧气浓度不应低于20%;麻醉终止后,应吸入纯氧10分钟,以防止缺氧。2.当病人有低血容量、休克或明显的心脏病时,可引起严重的低血压。氧化亚氮对有肺血管栓塞症的病人可能也是有害的。
【禁忌症】(1)气囊肿(2)肠梗阻、肠胀气(3)气胸(4)气脑(5)高头位开颅手术
【医学药品规格】 气体:用耐压铁筒装。
【贮藏】 置耐压钢瓶内,在凉暗处保存。
【作用与用途】吸入纯粹该品气体能迅速引起麻醉状态和窒息,因此,必须与氧混合使用。诱导时间短。若不补充维持剂量,可迅速苏醒。该品可用于马、反刍动物、犬和猫的维持麻醉。
【用法与用量】该品用耐高压钢瓶盛装。用于小动物麻醉:75%氧化亚氮同25%氧混合,通过面罩给予2-3分钟,然后再加入氟烷,使其在氧化亚氮和氧混合气体中达3%浓度,直至出现下颌松弛等麻醉征象为止。
增加车辆速度
使用氮氧加速系统的改装车辆将一氧化二氮送入引擎,遇热分解成氮气和氧气,提高引擎燃烧率,增加速度。氧气有助燃作用,加快燃料燃烧。
火箭氧化剂
一氧化二氮可以用作火箭氧化剂。这比其他氧化剂优势化处是因为它是无毒的,在室温下稳定,易于储存和相对安全地进行飞行。第二个好处是可以很容易分解成呼吸的空气。
制取方法
原理
硝酸铵在169.5℃熔融,在220℃分解成一氧化二氮和水
NH4NO3=加热=N2O↑+2H2O
用品
大试管、铁架台、酒精灯、水槽、集气瓶、干燥硝酸铵粉末
操作
1.在能适当加热的干燥装置中,在80--100℃的温度下,使硝酸铵充分干燥。然后用干的研钵磨碎,再在80--100℃的温度下干燥后,迅速放入瓶里加塞保存备用。
2.取2g上述干燥的硝酸铵,加入干燥的试管里,加热(剪短酒精灯的灯芯,使火焰不太大)后。硝酸铵熔融成液体,以后像水沸腾那样,气泡翻滚。用向上排空气法收集一氧化二氮气体。
备注
1.本实验加热的温度不宜过高。温度过高,可能分解生成氮气、一氧化氮和二氧化氮。特别是在高温下容易引起爆炸。
2.硝酸铵的用量控制在2g左右,以免发生爆炸。
3.试管口应略低于水平。这样就能避免反应生成的水跟加热部分接触,引起试管破裂。
4.2g硝酸铵在常温、常压下理论上能收集到610mL一氧化二氮,但由于部分熔融硝酸铵随生成的水流去,只能收集到300mL气体,用一只250mL集气瓶就可以了
另外还可以用无水硝酸钠和无水硫酸铵混合物加热分解制得
2NaNO3+(NH4)2SO4=2N2O↑+Na2SO4+4H2O
其他制取方法:1、3HNO3(很稀)+8Fe===8Fe(NO3)3+3N2O↑+15H2O
2、4Zn+10HNO3(很稀)===4Zn(NO3)2+N2O↑+5H2O 但是上面这些制备方法都是纸上谈兵,实施起来需要高温操作,比较危险,而且纯度还难以保证。
实际上实验室最方便的制备笑气的方法是碱分解硝基脲
O2N-NH-CO-NH2+NaOH==N2O↑+H2O+NaOCN
这个反应的原理是,硝基脲水中水解生成硝酰胺,H2N-NO2
O2N-NH-CO-NH2+H2O==H2N-NO2+H2O+HOCN
有碱存在时,HOCN与碱反应成盐,生成NaOCN
同时,碱催化下H2N-NO2发生脱水反应生成N2O,也就是笑气
H2N-NO2==N2O+H2O
盐酸羟胺和亚硝酸钠反应方程式
NH2OH·HCl+NaNO2=N2O+NaCl+2H2O
(归中反应)
将盐酸羟胺溶液与亚硝酸钠溶液混合即可生成大量笑气
应急处理
处置
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给予输氧。如呼吸停止,立即进行人工呼吸。就医。
呼吸系统防护:一般不需特殊防护。高浓度接触时可佩戴自吸过滤式防毒面具(半面罩)。
眼睛防护:一般不需特殊防护。
身体防护:穿一般作业工作服。
手防护:戴防化学品手套。
其他防护:避免高浓度吸入。进入罐、限制性空间或其他高浓度区作业,须有人监护。
泄漏应急处理:迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。尽可能切断泄漏源。合理通风,加速扩散。漏气容器要妥善处理,修复、检验后再用。
有害燃烧产物:氧化氮。
灭火方法:该品不燃。消防人员须佩戴防毒面具,穿全身消防服,在上风向灭火。用雾状水保持火场中容器冷却。迅速切断气源,用水喷淋保护切断气源的人员,然后根据着火原因选择适当灭火剂灭火。
环境效应
一 氧化二氮(N2O)是一种具有温室效应的气体,是《京都议定书》规定的6种温室气体之一。N2O在大气中的存留时间长,并可输送到平流层,同时,N2O也是导致臭氧层损耗的物质之一。
与二氧化碳相比,虽然N2O在大气中的含量很低,但其单分子增温潜势却是二氧化碳的310倍;对全球气候的增温效应在未来将越来越显著,N2O浓度的增加,已引起科学家的极大关注。目前,对这一问题的研究,正在深入进行。
管理信息
操作的管理:密闭操作,提供良好的自然通风条件。操作人员必须经过专门培训,严格遵守操作规程。远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。防止气体泄漏到工作场所空气中。避免与还原剂接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。
储存的管理:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30 ℃。应与易(可)燃物、还原剂分开存放,切忌混储。储区应备有泄漏应急处理设备。
运输的管理:采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、还原剂等混装、混运。夏季应早晚运输,防止日光曝晒。铁路运输时要禁止溜放。
废弃的管理:处置前应参阅国家和地方有关法规。废气直接排入大气。
毒理学资料
急性毒性:一氧化二氮作为吸入麻醉剂在医药上应用已久,目前已少用。吸入一氧化二氮和空气的混合物,当其中氧浓度很低时可致窒息;吸入80%一氧化二氮和氧气的混合物引致深麻醉,苏醒后一般无后遗作用。监测方法 1.现场应急监测方法
便携式气相色谱法。
2.实验室监测方法
监测方法 | 类别 | 来源 |
盐酸萘乙二胺分光光度法 | 空气 | 徐伯洪,闫慧芳主编:《工作场所有害物质监测方法》 |
气相色谱法 | ? | 参照《分析化学手册》(第四分册,色谱分析)(化学工业出版社) |
国家标准
1.中国职业接触限值(GBZ 2-2002)
2.环境标准
消耗臭氧
2009年8月29日,美国一项最新研究显示,这种无色有甜味的气体已经成为人类排放的首要消耗臭氧层物质。美国国家海洋和大气管理局地球系统研究实验室研究人员利用数学模型推算出,人类通过使用化肥、化石燃料等每年向大气中排放约1000万吨一氧化二氮,如果人类不采取措施限制其排放,它将成为21世纪破坏性最大的消耗臭氧层物质。
研究人员表示,根据1987年通过的《关于消耗臭氧层物质的蒙特利尔议定书》,人类逐步削减了氯氟烃、含溴氟烃等消耗臭氧层物质的使用,但一氧化二氮的使用和排放不受议定书限制,其对臭氧层的破坏作用也越来越明显。
有关这项研究成果的论文28日将发表在美国最新一期《科学》杂志上。研究人员在文章中表示,一氧化二氮也是一种温室气体,未来如果能够限制一氧化二氮的排放,不仅将有效加速地球臭氧层的恢复,并且还能减缓气候变化。
臭氧层是指距离地球25公里至30公里处臭氧分子相对富集的大气平流层。它能吸收99%以上对人类有害的太阳紫外线,保护地球上的生命免遭短波紫外线的伤害,因此被誉为地球生物的保护伞。人类活动曾导致南极上空的臭氧层出现大面积空洞。