在化学动力学中,反应速率常数,又称速率常数 k或 λ是化学反应速率的量化表示方式。
基本介绍
- 中文名:反应速率常数
- 外文名:reaction rate constant
- 浓度单位:一般用mol·L-1(摩尔升-1)
- 时间单位:用秒、分或小时的负一次方
- 影响因素:温度和反应物性质
简介
在化学动力学中,反应速率常数,又称速率常数k或λ是化学反应速率的量化表示方式。
对于反应物A和反应物B反应成生成物C的化学反应,反应速率可表示成此式:
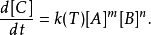
k(T)是反应速率常数,会随温度改变
[X]是假定反应发生处遍布于固定容积的溶液内,物质X的容积摩尔浓度。(当反应发生于一定範围,就能以X的单位面积摩尔数表示)
指数m和n称为反应级数,取决于反应机理。可由实验测定。
若为一次反应,亦可写成以下形式:
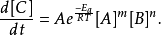
阿瑞尼斯方程式提供了反应进行中反应速率和活化能之关係的定量基础。
化学反应速率
反应速率即化学反应进行的快慢,单位为mol/(L·s)或mol/(L·min)。用单位时间内反应物的浓度的减少或生成物浓度的增加量来表示。浓度单位一般用摩尔·升-1,时间单位用秒、分或小时。化学反应并非均匀速率进行:反应速率分为平均速率(一定时间间隔里平均反应速率)和瞬时速率(给定某时刻的反应速率),可通过实验测定。反应物本身的性质,外界因素:温度,浓度,压强,催化剂,光,雷射,反应物颗粒大小,反应物之间的接触面积和反应物状态,x射线,γ射线,固体物质的表面积,与反应物的接触面积,反应物的浓度也会影响化学反应速率。
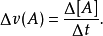
碰撞学说
碰撞理论,是由德国的Max Trautz及英国的William Lewis 在1916年及1918年分别提出的。
- 碰撞学说:任何化学反应的发生,必需反应粒子互相接近碰撞,则反应速率与碰撞次数成正比。
- 活化能:所谓活化能就是能使粒子发生反应的最低能量。
- 有效碰撞:所谓有效碰撞是指碰撞的粒子其能量超过活化能,且碰撞方向(位向)要正确(发生化学反应所需的能量)。
影响反应速率的因素
除了反应物的性质以外,浓度、温度和催化剂也是影响反应速率的重要因素。气体反应的快慢还与压力有关。增加反应物的浓度,即增加了单位体积内活化分子的数目,从而增加了单位时间内反应物分子的有效碰撞的次数,导致反应速率加快。提高反应温度,即增加了活化分子的百分数,也增加了单位时间内反应物分子有效碰撞的次数,导致反应速率加快。使用正催化剂,改变了反应历程,降低了反应所需的活化能,使反应速率加快。在化工生产中,常控制反应条件来加快反应速率,以增加产量。有时也要採取减慢反应速率的措施,以延长产品的使用时间。