在恆温恆压的条件下,化学反应过程中吸收或放出的热量称为反应热,用ΔH表示,单位kJ·mol-1
基本介绍
- 中文名:△H
- 外文名:△H
- 单位:kJ/mol
- 称为:反应热
概念
ΔH是化学反应焓变,焓是物体的一个热力学能状态函式,焓变即物体焓的变化量
公式
ΔH=ΔU+ΔpV,△H在等压且只做体积功条件下 ΔH=-Q
焓的物理意义可以理解为恆压和只做体积功的特殊条件下,Q=-ΔH,即反应的热量变化。因为只有在此条件下,焓才表现出它的特性。例如恆压下对物质加热,则物质吸热后温度升高,ΔH>0,所以物质在高温时的焓大于它在低温时的焓。又如对于恆压下的放热化学反应,ΔH<0,所以生成物的焓小于反应物的焓。
在化学反应中,因为H是状态函式,所以只有当产物和反应物的状态确定后,ΔH才有定值。
在发生化学反应时,首先要吸收能量,使反应物的化学键破坏,这一过程需要吸收反应物键能那幺多的能量.然后再形成新的化学键,这一过程是释放能量的,释放的能量为生成物的键能.
所以当△H小于0,是一个放热过程,吸收的能量小于释放的能量
反之就是△H大于0,就是吸热过程
比较H大小的方法
直接比较法
依据规律、经验和常识直接判断不同反应的△H的大小的方法可称为直接比较法。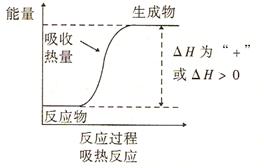 吸热反应
吸热反应
 吸热反应
吸热反应(1)吸热反应的△H肯定比放热反应的大(前者大于0,后者小于0);
(2)物质燃烧时,可燃物物质的量越大,燃烧放出的热量越多;
(3)等量的可燃物完全燃烧所放出的热量肯定比不完全燃烧所放出的热量多;
(4)产物相同时,气态物质燃烧放出的热量比等量的固态物质燃烧放出的热量多;
反应物相同时,生成液态物质放出的热量比生成等量的气态物质放出的热量多;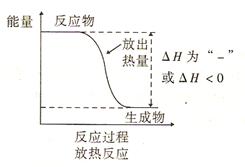 放热反应
放热反应
 放热反应
放热反应(5)生成等量的水时强酸的稀溶液反应比弱酸和强硷或弱硷和强酸或弱酸和弱硷的稀溶液反应放出的热量多;
(6)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的能量要小于相应热化学方程式中的数值。例如:2SO2(g) + O2(g)≒2SO3(g);△H= - 197kJ/mol-1,则向密闭容器中通入2mol SO2和1 mol O2,反应达到平衡后,放出的热量要小于197kJ。
图示比较法
画出化学变化过程中的能量变化图后,依据反应物的总能量与生成物的总能量的高低关係可以很方便地比较△H的大小。如图所示:
特别提醒
在比较反应放热或吸热大小时,只比较数值大小,没有正、负之分;而比较△H的大小,则要区分正、负,当△H > 0时,反应热数值越大,△H越大,当△H < 0时,反应热数值越大,△H越小。
注意:对于一个确定的化学反应,其焓变ΔH保持不变




